Fertilisation des cultures : des bases scientifiques renouvelées
| Les mots marqués d’un astérisque * lors de leur premier emploi dans le texte sont expliqués en annexe 1. |
Auteur : Gilles Lemaire
| Le point de vue de... | |
|---|---|
| Annexes de l'article | |
| Voir aussi (articles complémentaires) | |
| Autres langues | |
| Informations complémentaires | |
Article accepté le 22 janvier 2020
| |
| Article mis en ligne le 22 janvier 2020 |
Résumé
Les pratiques de fertilisation en agriculture basées sur une approche de pronostic de la réponse des cultures à l’apport d’éléments fertilisants ont permis des augmentations considérables du rendement des cultures depuis plus d’un siècle. La forte incertitude attachée à ces pronostics, même réduite autant que possible à l’aide d’un diagnostic basé sur les analyses de sol, a conduit les prescripteurs et les agriculteurs à maximiser les doses d’apport d’engrais du fait de leur aversion au risque d’une sous-fertilisation des cultures. Cette pratique généralisée a été la cause d’une mise en circulation excessive d’azote et de phosphore dans les agro-écosystèmes, qui est responsable d’impacts environnementaux négatifs importants qui ne sont plus acceptés par la société.
Une nouvelle approche, considérant la disponibilité des éléments nutritifs pour la plante, non plus comme un facteur externe à celle-ci, uniquement contrôlé par les apports de fertilisants et par leurs interactions physico-chimiques avec la matrice minérale du sol, mais comme une propriété émergente* du système plante – sol – microbiome*, permet de partir du diagnostic in situ de l’état de nutrition de la culture, qui de fait intègre la variabilité contextuelle et permet donc d’inférer avec une incertitude beaucoup plus faible les besoins en apports d’engrais des cultures et du même coup les risques environnementaux qui leur sont associés.
Introduction
Depuis le début des années 1950, les rendements en grain des principales cultures nécessaires directement ou indirectement à l’alimentation humaine ont été multipliés par un facteur 10, en grande partie grâce à une augmentation d’un facteur 7 de l’utilisation des engrais azotés et d’un facteur 3,5 de celle des engrais phosphatés (Tilman et al., 2002). Il s’agit donc d’un indéniable succès permettant de nourrir une population humaine toujours croissante sur des surfaces cultivables limitées. Cependant ce succès atteint aujourd’hui ses limites pour au moins deux raisons majeures :
- (1) La limitation des ressources en éléments fertilisants du fait que l’azote (N), essentiellement fourni par la réduction industrielle du N2 atmosphérique en ammoniac est en réalité une ressource limitée à l’avenir du fait de son coût en énergie fossile et des émissions de gaz à effet de serre qui accompagnent ce procédé industriel ; et du fait que le phosphore (P) et le potassium (K) sont extraits de minerais dont la ressource est limitée à l’échelle du globe.
- (2) La faible efficience d’utilisation des deux éléments N et P dans les systèmes agricoles, qui conduit à des augmentations excessives de leur circulation au sein des agro-écosystèmes, provoquant des impacts négatifs en cascade dans l’environnement (Galloway & Cowling, 2002).
Les recherches sur la nutrition minérale et la fertilisation des cultures ont été menées sur la base des paradigmes* issus des travaux pionniers de Boussingault (1855) et de Liebig (1855) au milieu du XIXe siècle. Ces paradigmes avaient pour objet la réponse des plantes et des cultures à des apports exogènes d’éléments minéraux sous formes d’engrais. L’aspect endogène de la disponibilité de ces éléments dans la dynamique de fonctionnement du système sol – plante – microbiote* du sol n’était donc pas pris en compte, et par conséquent les courbes de réponse obtenues expérimentalement étaient fortement dépendantes du contexte local sol – climat – plante et donc éminemment variables dans l’espace et dans le temps. Face à cette variabilité, l’utilisation des courbes de réponse comme outils de pronostic pour l’établissement des règles de fertilisation a donc engendré une forte incertitude qui a incité les prescripteurs et les agriculteurs à apporter des quantités d’engrais souvent excédentaires pour être certain de satisfaire « à coup sûr » les besoins de leurs cultures (Ravier et al., 2016). Cette pratique, encouragée par un faible prix des engrais comparé à ceux des produits agricoles, a conduit d’une part à négliger l’utilisation des déjections animales comme source d’éléments fertilisants, et d’autre part à des excès de fertilisation minérale qui, cumulés au cours des années, sont responsables des flux excessifs de N et P dans l’environnement observés aujourd’hui.
Il convient donc de re-questionner les paradigmes initiaux sur lesquels l’agronomie s’est en partie fondée en matière de nutrition minérale et de fertilisation des cultures, afin de réintroduire une vision plus dynamique du fonctionnement du système sol – plante - micro-organismes, qui puisse prendre en compte non seulement la réponse des plantes à des apports exogènes d’éléments nutritifs, mais aussi les nombreuses rétroactions endogènes qui confèrent au système ses propriétés adaptatives.
Les limites inhérentes à la Loi de Liebig, dite loi du minimum.
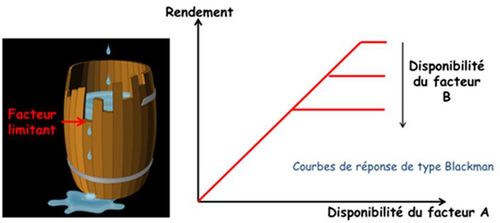
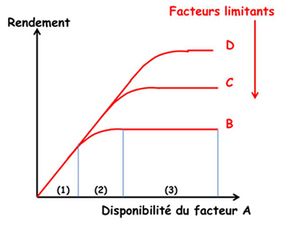
La « loi du minimum » de Liebig (1855) s’énonce de la manière suivante « Les plantes ne croissent qu’en fonction du niveau permis par l’élément nutritif qui est le plus limitant ». Son interprétation comme « loi des facteurs limitants » et sa traduction et son extension à l’ensemble des facteurs du milieu par les courbes dites de Blackman (1905) ont fait naître l’idée que la croissance des plantes était contrainte par des facteurs limitants successifs, indépendants entre eux, agissant ou se révélant de manière séquentielle au fur et à mesure où l’on agit sur le milieu par des mesures correctives (Figure 1).
Cette vision, complétée par la Loi de Mitscherlich (1924), qui montre que l’intensité de la réponse des plantes à un facteur donné est décroissante et donc asymptotique, a prévalu comme paradigme de base en agronomie et a été le cadre dans lequel s’est développé l’ensemble des recherches sur la fertilisation des cultures (Figure 2).
Cependant, dès 1885, Liebscher avait proposé une formulation plus complète de ce que voulait signifier Liebig sous la forme de la loi dite de l’optimum : « Chaque élément nutritif est utilisé de manière d’autant plus efficiente que la disponibilité de l’élément qui est le plus limitant est portée près de son optimum », ce qui ouvrait la voie à une analyse plus globale en explicitant l’existence d’interactions entre les éléments, au-delà du simple effet « tout ou rien » de la loi de Liebig telle qu’elle avait été formulée et interprétée. Mais, curieusement, les travaux de Liebscher sont restés relativement méconnus, et c’est sur la base de la Loi de Liebig et son interprétation assez simplifiée que l’agronomie a été enseignée à travers le monde. Ceci a eu pour effet une division excessive des recherches sur la nutrition des plantes et la fertilisation des cultures en compartimentant la réponse des plantes à chacun des éléments, N, P, K, micro- et oligo-éléments, allant même jusqu’à la spécialisation des équipes de recherches pour chaque élément particulier.
L’analyse des courbes de réponse des cultures aux apports croissants d’éléments nutritifs à l’aide des outils statistiques et de l’expérimentation « au champ » a donc été la base des recherches en agronomie de 1950 à 1990 environ, ne traitant éventuellement des interactions entre éléments que par le biais des résidus de variations expérimentales non expliquées par les effets élémentaires.
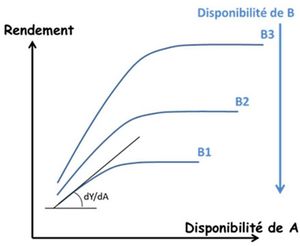
Il est maintenant bien établi que la loi de Liebig ne permet pas de rendre compte des interactions entre tous les facteurs du milieu, non seulement les éléments nutritifs entre eux, mais aussi avec les autres ressources telles que l’eau (Sinclair & Park, 1993 ; Cossani & Sadras, 2018). La raison en est que la croissance des plantes ne résulte pas d’une séquence linéaire de processus, chacun d’eux étant limité par un facteur donné, mais plutôt de boucles de processus eux-mêmes gouvernés par plusieurs facteurs à la fois (Rabinovitch, 1951). Les recherches sur la nutrition des cultures en agronomie ont été tout naturellement dominées par cette vision linéaire et séquentielle des facteurs du milieu, par le fait qu’elles étaient « finalisées et guidées » par l’étude de la réponse des cultures à une action anthropique comme la fertilisation. Dans le même temps et parallèlement, les recherches en Écologie fonctionnelle*, guidées par la seule compréhension du fonctionnement des couverts végétaux in natura, ont développé des approches très différentes basées sur le concept de co-limitation* entre facteurs du milieu (Bloom et al., 1985 ; Kho, 2000). Ce concept de co-limitation se rapproche davantage de la vision de Liebscher que de celle de Liebig et permet d’expliciter formellement les nombreuses interactions et rétroactions qui entrent en jeu dans le fonctionnement du système plante – sol. Cette approche de modélisation dynamique du fonctionnement des couverts végétaux, initiée par les travaux de De Wit (1992, 1994) a permis d’expliciter les processus d’acquisition et d’allocation des ressources, ainsi que les concepts d’efficience de conversion des ressources qui sont à la base de tous les modèles actuels de fonctionnement des couverts végétaux et donc des cultures (Hanks & Ritchie, 1991 ; Monteith et al., 1994). Cette approche a été appliquée essentiellement aux ressources telles que la lumière, le CO2 ou l’eau, mais plus rarement aux éléments nutritifs.
La grande variabilité des courbes de réponses des cultures aux apports d’éléments nutritifs, obtenues expérimentalement par les agronomes, a incité ceux-ci à spécifier les variables locales du sol susceptibles de résorber une partie de l’incertitude du « pronostic » qui pouvait en être déduit. La Science du Sol s’est donc tout naturellement emparée du problème des interactions entre les différents éléments nutritifs et la matrice minérale du sol, pour tenter de quantifier la « disponibilité » in situ de ces éléments pour les plantes. Ainsi l’approche physico-chimique de la nutrition minérale a engendré une interprétation plus mécaniste des courbes de réponse en proposant un « diagnostic du sol » comme co-variable contextuelle permettant d’inférer un « pronostic de nutrition » de la culture. Mais, restant dans le cadre conceptuel de la loi de Liebig, cette approche explicative physico-chimique a concentré son effort sur le concept de « disponibilité » de chacun des éléments pris séparément, alors que les concepts de co-limitation et de stoechiométrie* développés en Écologie fonctionnelle, qui permettaient une vision systémique de la nutrition des plantes, n’ont que très rarement été pris en compte par les agronomes (Reich et al., 2018).
Pour les éléments nutritifs les moins mobiles, ayant les plus fortes interactions avec la matrice minérale des sols, le concept de « disponibilité » a été formulé au moyen de valeurs seuils issues de tests physico-chimiques réalisés par des analyses de sol in vitro, essayant de traduire ainsi la capacité qu’auraient les plantes à prélever chacun des éléments indépendamment les uns des autres en fonction des interactions plus ou moins fortes de ces éléments avec la matrice minérale du sol. Cette approche normative, basée sur des valeurs seuils déterminées empiriquement, a permis un raisonnement des pratiques de fertilisation en fonction des types de sols et de leurs histoires culturales, et a permis et accompagné la formidable expansion de la fertilisation des cultures et l’augmentation associée des rendements dans les agricultures développées. Il s’agit donc d’un indéniable succès. Cependant, la capacité prédictive de cette approche pour la détermination de la dose optimale d’apport de fertilisant pour les différentes cultures reste encore aujourd’hui relativement limitée (Valkama et al., 2011). Le principal écueil de cette approche normative est qu’elle considère la « disponibilité » de chacun des éléments séparément : elle ignore les synergies ou antagonismes entre éléments, mais aussi et surtout ne considère pas les autres composantes du système, la plante elle-même et le compartiment biologique du sol, comme acteurs effectifs de cette « disponibilité ». En externalisant la disponibilité des éléments nutritifs, c’est-à-dire en la considérant comme une donnée du milieu « externe à la plante », cette approche ne peut en aucun cas prendre en compte les nombreux processus, interactions et rétroactions qui in fine déterminent la capacité qu’ont les plantes à absorber les éléments présents dans leur environnement racinaire. La disponibilité des éléments nutritifs doit au contraire être considérée comme résultante de la dynamique interne du système et comme l’expression de ses propriétés émergentes.
Pour les éléments mobiles comme l’azote (N), les agronomes se sont très tôt aperçus qu’il convenait de faire coïncider les apports de fertilisants avec la dynamique du besoin des cultures, la matrice minérale du sol jouant alors un rôle très mineur. Là encore, l’approche linéaire entre apports sous forme d’engrais et réponses en terme de rendement a montré ses limites face à l’énorme variabilité des fournitures d’azote par la minéralisation des matières organiques du sol, et la non moindre variabilité des besoins instantanés des plantes (Bramley et al., 2013), ainsi que cela est illustré Figure 4.
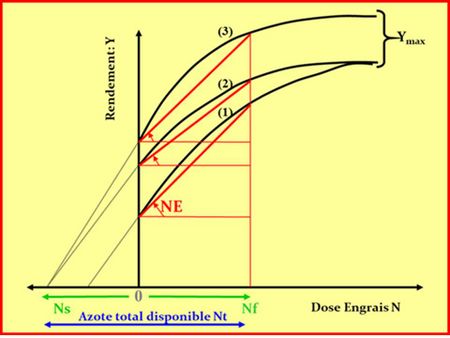
Afin de surmonter cet obstacle d’imprévisibilité des réponses des cultures à l’apport d’engrais azoté, les agronomes français ont tenté de prévoir la disponibilité en azote dans le sol pour les cultures en établissant un bilan prévisionnel d’azote minéral dans un contexte de sol et de climat donné (Hébert, 1969 ; Rémy & Hébert, 1977 ; Meynard et al., 1997). Cette approche, synthétisée par Machet et al. (2017), permet de prévoir approximativement la quantité d’azote qui serait « disponible » pour une culture donnée sur l’ensemble de son cycle de croissance, en faisant un bilan entre (1) un pronostic de la fourniture de N par la minéralisation de la matière organique du sol, (2) une mesure de reliquat de N minéral dans le sol, et (3) une estimation des pertes par volatilisation, dénitrification et lixiviation. Bien que cette méthode soit capable de réduire fortement l’incertitude de la réponse de la culture aux apports d’azote, sa capacité de prédiction dans une situation donnée reste trop imprécise et donne donc encore lieu à des pratiques de fertilisation de type « assurance» liées à l’aversion aux risques des agriculteurs (Ravier et al., 2016 ; 2018), conduisant à des fertilisations excédentaires qui restent encore non compatibles avec la préservation de l’environnement (Meynard et al., 2002).
Aujourd’hui, les approches de type « pronostics », qu’elles soient basées sur des tests de type « analyses de sols » pour P, K et autres minéraux, ou sur des modélisations empiriques de bilans de N, conduisent à des décisions en matière de fertilisation des cultures qui sont en général excédentaires du seul fait de la grande incertitude qui reste attachée à la prévision dans un contexte particulier. Il en découle donc une incapacité à ajuster les apports de fertilisants au strict besoin des cultures, causant des impacts environnementaux importants dans les régions d’agriculture intensive, alors que d’autres régions du monde restent largement sous-fertilisées (Ringeval et al., 2017).
Pour une approche du diagnostic in situ de l’état de nutrition des cultures
Si les pronostics basés sur des « diagnostics sol », de type analyses de sols P, K etc… ou de type « bilan N », s’avèrent trop imprécis pour fonder des décisions en matière de fertilisation des cultures, pourquoi alors ne pas observer directement l’état de nutrition minérale des plantes in situ ? C’est ce que permet théoriquement le concept de concentration critique des plantes en éléments nutritifs défini par Ulrich (1952) comme « le minimum de concentration en un élément minéral particulier nécessaire pour obtenir la croissance maximale de la plante ». Donc, en comparant à chaque instant la concentration réelle de la plante en un minéral particulier (% M) à la concentration critique (% Mc), il doit être possible de qualifier et de quantifier une carence ou un excès de nutrition en cet élément. C’est le principe du diagnostic foliaire (Smith, 1962 ; Cornforth et al., 1981), qui a été particulièrement mis en œuvre aux USA (Walworth & Summer, 1987), permettant notamment un diagnostic multi-éléments des cultures in situ. Cette pratique a été particulièrement utilisée dans le cas des vergers avec cependant la question toujours latente de la représentativité d’un échantillon de feuilles à l’échelle d’un verger. Plus récemment, c’est aussi le principe du diagnostic azoté des cultures utilisant les propriétés de réflectance* des couverts végétaux qui peuvent être corrélées à la concentration en N des plantes (Barret & Fourty, 1994 ; Cao et al., 2016), visant un pilotage en temps réel des apports d’azote grâce à des mesures de télédétection*.
Mais ces diagnostics « plante » ont longtemps buté sur l’absence de références stables et suffisamment génériques* en termes de concentration critique % Mc. Ces valeurs critiques se sont avérées assez variables en fonction des espèces et cultivars, des stades phénologiques, des saisons, etc., donnant lieu à des tentatives nombreuses et infructueuses de normalisation et de définition de valeurs seuils, qui ont rendu cette approche rapidement très décevante malgré sa simplicité apparente.
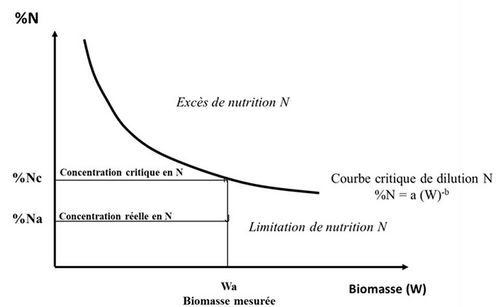
Pendant ce temps, les recherches en écologie fonctionnelle sur les végétations naturelles forestières ou prairiales ont fait ressortir les aspects intégratifs et adaptatifs de l’acquisition, de l’allocation et du recyclage des éléments nutritifs au sein de l’écosystème (Blum, 1977 ; Agren, 2004 ; Niklas et al., 2005). Bien que rarement utilisée par les agronomes, l’allométrie*, c’est-à-dire l’analyse de croissance comparée des divers compartiments d’un organisme vivant, a permis de rendre compte des rétro-contrôles qui lient l’acquisition et l’allocation des ressources à la capacité de croissance des plantes. Ainsi les études de Lemaire et Salette (1984) sur les peuplements de graminées fourragères, de Lemaire et al. (1985) sur la luzerne et leur extension par Greenwood et al. (1990) à un large panel d’espèces en C3 et C4* cultivées ont débouché sur le concept de courbes de dilution de l’azote (Lemaire et al., 2008), montrant que la teneur en N critique des plantes diminue avec l’accumulation de biomasse du peuplement végétal du fait d’une allométrie entre prélèvement d’azote et accumulation de biomasse. Ainsi une interprétation de la concentration en azote des plantes à un moment donné dans une culture donnée (% Nact) peut être faite en référence à une valeur critique (% Ncrit) grâce à un indice de nutrition azotée INN = % Nact / % Ncrit, facilement mesurable à tout instant, et dont une valeur inférieure à 1 indique et quantifie le déficit de nutrition azotée de la culture, alors qu’une valeur supérieure à 1 quantifie un excès ou une « consommation de luxe » d’azote. (Figure 5)
Initialement développée de manière empirique, cette approche a été progressivement étayée par une analyse théorique de la nutrition azotée des plantes, qui met en exergue un certain nombre de régulations internes au système plante-sol :
- (1) Une co-régulation* de l’absorption d’azote par la concentration en N minéral du milieu racinaire et par la vitesse de croissance potentielle de la plante elle-même, qui établit que la « disponibilité en azote du sol » dépend aussi de la plante elle-même (Lejay et al., 1999 ; Devienne-Barret, 2000).
- (2) Une accumulation d’azote dans la plante, qui est proportionnelle à la taille de son compartiment métabolique, lequel est déterminé par sa surface foliaire éclairée (Caloin & Yu, 1984 ; Lemaire et al,. 2007).
- (3) Une allocation d’azote dans la plante qui est sous la dépendance du développement architectural de la plante, sans lien direct avec des stades phénologiques (Ratgen et al., 2018).
De cet ensemble de données écophysiologiques, il ressort deux conclusions importantes :
- (1) La disponibilité en azote ne peut plus être considérée seulement comme un facteur externe exprimé par un stock ou une concentration dans le sol, aux variations desquels la plante, et donc la culture, exprimeraient une réponse. Il convient aussi et surtout d’exprimer la propriété qu’a la plante de moduler sa capacité d’absorption de N en fonction de sa propre vitesse de croissance, et le rôle du microbiome du sol comme acteur de cette disponibilité en azote, à la fois positivement via la minéralisation des matières organiques du sol, mais aussi négativement via ses propres besoins en azote (immobilisation de N). La disponibilité de l’azote pour la plante doit donc être considérée comme une variable interne au système plante – sol – microbiome résultant d’un équilibre dynamique entre ses différentes composantes. Il s’ensuit donc que, d’une approche linéaire de type « action–réponse », on doit passer à une approche circulaire et systémique où les effets rétroagissent constamment sur les causes.
- (2) Le diagnostic nutritionnel de la plante ne peut plus se faire de manière univoque par la seule détermination de sa concentration en azote puisque celle-ci évolue avec la croissance de la plante. Il convient donc de comparer des cultures de même biomasse et donc à même niveau de dilution de l’azote.
Une revue récente (Lemaire et al., 2019) montre l’emboîtement théorique étroit entre les échelles de la plante et du peuplement, expliquant la généricité des relations d’allométrie entre la dynamique de croissance d’une culture et sa dynamique de prélèvement d’azote et explicitant du même coup les propriétés émergentes observables à l’échelle de la culture. Cette même revue montre également la transposition du concept de dilution tel qu’il a été conçu pour l’azote, aux autres éléments minéraux impliqués dans le métabolisme de la plante, P, K et S. Il est ainsi possible de déterminer, à l’instar de l’INN pour l’azote, des indices de nutrition P (INP) ou K (INK) à partir de la définition des courbes critiques de dilution P et K (Duru & Thellier, 1997 ; Salette & Huché, 1991) et aussi de rendre compte des interactions N-P et N-K par la détermination d’indices P/N ou K/N montrant que ces éléments sont en étroite interaction, la disponibilité de l’un ayant une influence importante sur la disponibilité de l’autre (Ziadi et al., 2007 & 2008).
Cette nouvelle vision de la nutrition minérale des cultures considère que les rétroactions entre processus au sein du système sol – plante – microbiome du sol se traduisent par des propriétés émergentes du système lui-même, ce qui lui confère des propriétés auto-adaptatives et évolutives qui ne peuvent s’analyser que de manière dynamique. Une telle approche doit donc remplacer la vision linéaire considérant la réponse du système à une sollicitation exercée sur un facteur externe à celui-ci, telle qu’elle a été conçue par les paradigmes initiaux de l’agronomie. La complexité de la dynamique de ce système, examinée des points de vue physico-chimique et biologique, en rend toute prévision d’évolution entachée d’une très grande incertitude. L’abandon d’une approche de « pronostic » et son remplacement par une approche de « diagnostic » apparaît donc nécessaire. Ceci est d’autant plus clair que les recherches récentes, tant en physiologie végétale qu’en écologie du sol, montrent que :
- (1) Les plantes sont capables de percevoir directement des signaux concernant la présence et la concentration des éléments minéraux dans leur milieu, de transmettre des signaux de déficience ou de satiété en différents éléments nutritifs depuis leurs parties aériennes vers leurs racines et moduler ainsi en conséquence leur propre capacité d’absorption dans le cadre de réponses intégrées (Briat et al., 2015 & 2020 ; O’Brien et al., 2016 ; Ohkubo, 2017), rendant donc celles-ci actrices de la disponibilité de ces éléments dans le milieu;
- (2) Le microbiome des sols, lui-même sous la dépendance nutritionnelle de la plante, rétroagit sur la biodisponibilité des éléments minéraux dans le sol (Briat et al., 2020), soit en l’augmentant grâce à ses capacités de captation dans le cadre de symbioses, soit au contraire comme compétiteurs vis-à-vis de la plante elle-même (immobilisation).
Ainsi, en ignorant la plante et le microbiome du sol comme agents effectifs de la disponibilité des éléments nutritifs dans le sol, les paradigmes qui ont fondé les recherches en agronomie sur la nutrition minérale et la fertilisation des cultures n’ont pu aborder qu’une seule face du système : l’optimisation de la production agricole par la fertilisation, mais se trouvent incapables d’analyser les deux faces du problème : la production et l’environnement.
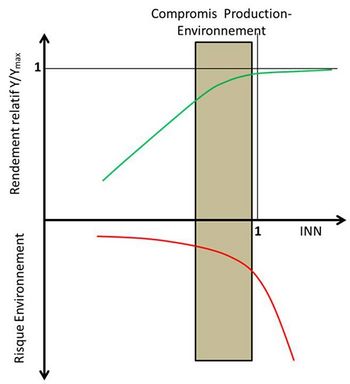
L’approche de diagnostic de nutrition minérale des cultures, parce que basée sur des propriétés émergentes résultant des facultés d’auto-adaptation du système sol – plante – microbiome, rend compte d’un état global interne de ce système, duquel on peut inférer aussi bien des niveaux de production possibles d’une culture que des risques environnementaux encourus, compte tenu du niveau de nutrition azotée (INN) de cette culture. Il est donc possible de prendre en compte le compromis à trouver entre les deux objectifs de production agricole et de préservation de l’environnement. En effet, un diagnostic de nutrition en azote ou phosphore d’une culture nous renseigne non seulement sur son niveau de satisfaction en ces deux éléments, et donc de son niveau de rendement possible, mais encore sur la facilité de circulation de ces éléments entre les éléments du système sol – plante – microbes – matières organiques, en d’autres mots, du degré de couplage ou de découplage de ces éléments avec le carbone du sol (Rumpel & Chabbi, 2019 ; Recous et al., 2019), et donc sur les risques potentiels d’émission dans le milieu sous forme de nitrate dans les hydro-systèmes, et de N2O dans l’atmosphère.
Ainsi on propose de renverser totalement l’approche de la nutrition minérale et de la fertilisation des cultures. Le paradigme ancien consistait à étudier la réponse des cultures à un apport croissant d’élément fertilisant conformément au schéma de la figure 4, dans lequel la culture « témoin », sans apport exogène d’azote minéral, s’avère soumise à la plus grande source de variabilité, celle-ci étant due à la fois au sol et au climat. La réponse à l’apport d’engrais minéral ne peut donc pas être interprétée de manière fonctionnelle et reste soumise à un grand degré d’incertitude due à l’absence de témoin « invariant ». L’approche nouvelle au contraire prend comme témoin la culture non-limitée en azote, et grâce au diagnostic de nutrition azotée de la culture in situ (INN), il est possible d’établir une loi ayant une valeur générique quantifiant la réponse, non plus à des apports croissants de N, mais à l’intensité de déficit de nutrition azotée de la culture correspondant à la valeur 1-INN (Figure 6). Ce renversement de paradigme permet alors d’incorporer les variables contextuelles locales dans la valeur de l’INN observée in situ, et de faire ressortir une loi plus générique de réponse d’une culture au niveau de déficit en N qu’elle subit réellement dans les conditions spatiales et temporelles dans lesquelles ce diagnostic a été réalisé. De plus, ce diagnostic étant basé sur un état du peuplement végétal dans son milieu réel, il prend en compte l’ensemble des interactions entre les trois composantes du système, la plante, le sol et le microbiome, et on est en droit d’en inférer un comportement global de ce système qui doit pouvoir être traduit en termes de risques environnementaux.
Le diagnostic d’une culture in situ ainsi réalisé par la détermination de l’INN devient de facto un diagnostic du milieu (sol – plante – microbiome) qui a permis d’atteindre ce niveau de nutrition azotée de la culture. L’INN de la culture peut donc être considéré comme révélateur d’un état du milieu qui lui a permis d’atteindre un niveau de satisfaction donné de ses besoins en N. Il devient alors possible de relier cet indicateur INN à des risques potentiels d’émissions de nitrate vers les eaux souterraines et superficielles et de N2O dans l’atmosphère, qui doivent en premier lieu dépendre du degré de disponibilité de l’azote minéral dans le milieu. Ceci peut être aussi bien appliqué au phosphore et à son indicateur de disponibilité l’INP. Ainsi comme illustré dans la Figure 6, le compromis entre niveau de production d’une culture et risques environnementaux peut-être analysé et quantifié en utilisant le même indicateur. Ceci demande bien entendu encore des recherches pour mieux quantifier la relation existante entre l’INN ou l’INP et les risques correspondants dans un milieu donné. Mais cette possibilité de diagnostic de culture en temps réel ayant une double signification, en termes à la fois de production agricole et d’impact environnemental, permet d’entrevoir une perspective nouvelle pour l’agronomie.
Conclusion
Ainsi, un changement de paradigme est devenu possible et est mis progressivement en action grâce aux outils de télédétection qui permettent d’avoir un diagnostic en temps réel de l’état de nutrition d’une culture. D’une approche linéaire de pronostic de réponse des cultures à des apports exogènes d’éléments nutritifs, affectée d’une grande incertitude pour son application contextuelle locale, il est possible de passer à une approche de diagnostic local dont la signification générique est étayée par un corpus théorique cohérent. Du coup, ce changement de paradigme permet d’effacer le niveau d’incertitude lié au pronostic, grâce à l’aptitude du diagnostic in situ à rendre compte de la diversité des contextes. La possibilité de répétition spatiale et temporelle des diagnostics in situ permet une adéquation plus étroite des décisions au contexte local. C’est ainsi que le couplage entre diagnostic in situ en temps réel et les outils de décision de fertilisation des cultures grâce à la télédétection dans le cadre de l’agriculture de précision ouvre techniquement la porte à des pratiques essentiellement correctives, à la fois dynamiques et plus précises, permettant d’assurer le maintien du statut nutritionnel des cultures à un niveau jugé à la fois optimum pour les objectifs de production et compatible avec l’environnement. Cependant, les recherches doivent se concentrer justement sur les termes de ce compromis entre optimum de production et impacts environnementaux dont les poids respectifs sont variables en fonction non seulement des contextes agronomiques et écologiques, mais aussi économiques et sociopolitiques.
Références citées
- Agren G.I. 2004. The C : N : P stoichiometry of autotrophs—theory and observations. Ecology Letters, 7 : 185-191.
- Barret F., Fourty T. 1994. Radiometric estimate of nitrogen status of leaves and canopies. In (Lemaire G., ed) : Diagnosis of the nitrogen status in crops. Springer, Heidelberg, pp 201-227.
- Blackman F.F., 1905. Optima and limiting factors. Ann. Bot., 19, 281–295.
- Bloom A.J., Chapin F.S., Mooney H.A., 1985. Resource limitations in plants – An economic analogy. Ann. Rev. Ecol. Syst., 16 : 363-92.
- Blum J.J. 1977. On the geometry of four-dimensions and the relationship between metabolism and body mass. Journal of Theoretical Biology, 64 : 599-601.
- Boussingault J.B., 1855. Recherches sur la végétation. De l’action du salpêtre sur le développement des plantes. Journal de Pharmacie et de Chimie, 3e série, 25 : 122-131.
- Bramley R.G.V., Lawes R.A., Cook S.E., 2013. Spatially distributed experimentation. In : Oliver M.A., Bishop T., Marchant B. (eds.), Precision Agriculture for Sustainability and Environmental Protection. Routledge, pp. 205-218. doi.org/10.4324/9780203128329.
- Briat J.F., Rouached H., Tissot N., Gaymard F., Dubos C. 2015. Integration of P, S, Fe, and Zn nutrition signals in Arabidopsis thaliana : potential involvement of Phosphate Starvation Response 1 (PHR1). Front Plant Sci., 28 (6) : 290.
- Briat J.F. Gojon A., Rouached H., Plassard C., Lemaire G., 2020. Reappraisal of the concept of nutrient availability for plants in soils at the light of the recent molecular physiology advances. European Journal of Agronomy (submitted).
- Caloin M., Yu O., 1984. Analysis of the time course change in nitrogen content of Dactylis glomerata L. using a model of plant growth. Ann. Bot., 54 : 69-76.
- Cao Q., Miao Y.X., Shen J.N., Yu W.F., Yuan F., Cheng S.S., Huang S.Y., Wang H.Y., Yang W., Liu F.Y., 2016. Improving in-season estimation of rice yield potential and responsiveness to topdressing nitrogen application with Crop Circle active crop canopy sensor. Precis. Agric., 17: 136-154. doi.org/10.1007/s11119-015-9412-y.
- Cornforth I.S.; Steele K.W. 1981. Interpretation of maize leaf analysis in New Zealand. NZ journal of experimental agriculture, 9 : 91-96.
- Cossani C.M., Sadras V.O., 2018. Water-nitrogen co-limitation in grain crops. Adv. Agron., 150 : 231–274.
- Devienne-Barret F., Justes E., Machet J.M., Mary B., 2000. Integrated control of nitrate uptake by crop growth rate and soil nitrate availability under field conditions. Ann. Bot., 86 : 995-1005. doi : 10.1006/anbo.2000.1264
- De Wit C.T., 1994. Resource use analysis in agriculture: a struggle for interdisciplinarity. In : Fresco L.O., Stroosnijder L., Bouma J., van Keulen H. (eds.), The Future of the Land : Mobilizing and Integrating Knowledge of Land Use Options. Wiley, NewYork, pp. 41-55.
- Duru M., Thellier L., 1997. N and P-K status of herbage: use for diagnosis of grasslands. In: Lemaire G., Barns I., eds, Diagnostic procedures for crop N management and decision making. Science Update, INRA Editions, Paris.
- Galloway J.N., Cowling E.B., 2002. Reactive nitrogen and the world: 200 years of change. Ambio 3 : 64-71.
- Greenwood D.J, Lemaire G., Gosse G., Cruz P., Draycott A., Neeteson J.J., 1990. Decline in percentage N of C3 and C4 crops with increasing plant mass. Ann. Bot., 66 : 425-436.
- Hanks J., Ritchie J.T. (eds.), 1991. Modelling Plant and Soil Systems. Agronomy Monograph No. 31, American Society of Agronomy, Madison, 545 p.
- Hébert J., 1969. La fumure azotée du blé tendre d’hiver. Bulletin Technique d'Information 244 : 755-766.
- Kho R.M., 2000. On crop production and the balance of available resources. Agriculture, Ecosystems and Environment 80: 71-85
- Lejay L., Tillard P., Lepetit M., 1999. Molecular and functional regulation of two nitrate uptake systems by N and C-status of Arabidopsis plants. Plant J., 18: 509-519.
- Lemaire G., Salette, J. 1984. Relation entre dynamique de croissance et dynamique de prélèvement d’azote pour un peuplement de graminées fourragères. I - Etude de l’effet du milieu. Agronomie, 4 (5) : 423-430.
- Lemaire G., Cruz P., Gosse G., Chartier M., 1985. Étude des relations entre la dynamique de prélèvement d’azote et la dynamique croissance en matière sèche d’un peuplement de luzerne (Medicago sativa L.). Agronomie, 5 : 685-692.
- Lemaire G., Jeuffroy M.H., Gastal F., 2008. Diagnosis tool for plant and crop N status in vegetative stage. Theory and practices for crop N management. Eur. J. Agron., 28 : 614-624. doi : 10.1016/j.eja.2008.01.005
- Lemaire G., van Oosterom E., Sheehy J., Jeuffroy M.H., Massignam A., Rossato L., 2007. Is crop demand more closely related to dry matter accumulation of leaf area expansion during vegetative growth? Field Crops Res., 100 : 91-106. https : //doi.org/10.1016/j.fcr.2006.05.009
- Lemaire G., 2019. Allometric approach to crop nutrition and implications for crop diagnosis and phenotyping. A review. Agronomy for Sustainable Development (in press).
- Liebig J. von, 1855. Die Grundsätze der Agricultur-Chemie mit Rücksicht auf die in England angestellen Untersuchungen. 2 Auflage, Braunschweig, 107 p.
- Liebscher G., 1895. Untersuchungen über die Bestimmung des Düngerbedürfnisses der Ackerböden und Kulturpflanzen. J. Landwirtsch., 43: 49-216.
- Machet J-M., Dubrulle P., Damay N., Duval R., Julien J.-L., Recous S., 2017. A Dynamic Decision-Making Tool for Calculating the Optimal Rates of N Application for 40 Annual Crops while Minimising the Residual Level of Mineral N at Harvest. Agronomy, 7, 73; doi : 10.3390/agronomy7040073
- Meynard J.M., Justes E., Machet J.M., Recous S., 1997. Fertilisation azotée des cultures annuelles de plein champ. In : Lemaire G., Nicolardot B. (eds), Maîtrise de l’azote dans les Agrosystèmes. INRA Paris, France, Les Colloques de l'INRA, Vol. 83 : 183-200.
- Meynard J-M., Cerf M., Guichard L., Jeuffroy M-H., Makowski D., 2002. Which decision support tools for the environmental management of nitrogen? Agronomie 22 : 817-829. DOI : 10.1051/agro : 2002064
- Mitscherlich E.A., 1924. Die Bestimung des Düngerbedürfnisses des Bodens. Paul Parey, Berlin, 100 p.
- Monteith J.L., 1994. Principles of resource capture by crop stands. In : Monteith J.L., Scott R.K., Unsworth M.H. (eds.), Resource Capture by Crops. Proc. of Easter Schools in Agricultural Science, Nottingham University Press, Nottingham, pp. 1-15.
- Niklas K.J., Owens T., Reich P.B., Cobb E.D., 2005. Nitrogen/phosphorus leaf stoichiometry and the scaling of plant growth. Ecol. Lett., 8: 636–642.
- O’Brien J.A., Vega A., Bouguyon E., Krouk G., Gojon A., Coruzzi G., Gutierrez R.A. 2016 Nitrate transport, sensing and responses in plants. Molecular Plant, 9 : 837-856.
- Ohkubo Y., Tanaka M., Tabata R., Ogawa-Ohnishi M., Matsubayashi Y., 2017 Shoot-to-root mobile polypeptides involved in systemic regulation of nitrogen acquisition. Nature Plants, 3 : 17029
- Rabinovitch E.L., 1951. Photosynthesis and Related Processes. Vol. II, Part 1. Interscience Publishers, New York, pp. 858-885.
- Ratjen A.M., Lemaire G., Kage H., Plénet D., Justes E., 2018. Key variables for simulating leaf area and N status : biomass based relations versus phenology driven approaches. Eur. J. Agron., 100 : 110-117. doi : 10.1016/j.eja.2018.04.008
- Ravier C., Jeuffroy M.H., Meynard J.M., 2016. Mismatch between a science-based decision tool and its use : The case of the balance-sheet method for nitrogen fertilization in France. NAJS-Wageningen Journal of Life Science 79 : 31-40. doi.org/10.1016/j.njas.2016.10.001.
- Ravier C., Jeuffroy, M-H., Gate P., Cohan J-P., 2018. Combining user involvement with innovative design to develop a radical new method for managing N fertilization. Nutr. Cycl. Agroecosyst. 20 (110) : 117-134. doi.org/10.1007/s10705-017-9891-5.
- Recous, S., Lashermes G., Bertrand I., Duru M., Pellerin M., 2019. C-N-P decoupling processes linked to arable cropping management systems in relation with intensification of production. In : Lemaire G, de Facio Carvalho P.C., Kronberg S., Recous S. (eds), Agrosystem diversity. Reconciling contemporary agriculture and environment. Elsevier, Academic Press.
- Reich P.B., Oleksyn J., Wright I.J., Niklas K.J., Hedin L., Elser J.J., 2018. Evidence of a general 2/3-power law of scaling leaf nitrogen to phosphorus among major plant groups and biomes. Proc. R. Soc. B., 277 : 877-883. doi : 10.1098/rspb.2009.1818.
- Rémy J.C.; Hébert J. 1977. Le devenir des engrais azotés dans le sol. C. R. Acad. Agric. Fr., 63: 700-714
- Ringeval B., Augusto L., Monod H., van Apeldorn D., Bouwman L., Yang X., Achat D.L., Chini L.P., van Oost K., Guenet B., Wang R., Decharme B., Nesme T., Pellerin S., 2017. Phosphorus in agricultural soils : drivers of its distribution at the global scale. Global Change Biology, doi : 10.1111/gcb.13618.
- Rumpel C., Chabbi A., 2019. Plant-Soil interactions control CNP coupling and decoupling processes in agroecosystems with perenniem vegetation. In : Lemaire G, de Facio Carvalho P.C., Kronberg S., Recous S. (eds), Agrosystem diversity. Reconciling contemporary agriculture and environment. Elsevier, Academic Press. ISBN : 978-0-12-811050-8.
- Salette J, Huché L (1991) Diagnostic de 1'état de nutrition minérale d'une prairie par l'analyse minérale du végétal: principes, mise en oeuvre, exemples. Fourrages 125, 3–18.
- Sinclair T.R., Park W.I., 1993. Inadequacy of the Liebig limiting-factor paradigm for explaining varying crop yields. Agron. J., 85 : 742–746
- Smith P.F., 1962. Mineral analysis of plant tissues. Ann. Rev. Plant Physio., 13 : 81-108.
- Soussana J.F., Lemaire G., 2014. Coupling C and N cycles for environmentally sustainable intensificationof grasslands and crop-livestock systems. Agriculture, Ecosystem & Environment, 190: 9-17.
- Tilman D., Cassman K.G., Matson P.A., Naylor R., Polasky S., 2002. Agricultural sustainability and intensive production practices. Nature, 418 (6898) : 671-677.
- Ulrich A., 1952. Physiological bases for assessing the nutritional requirements of plants. Ann. Rev. Plant Physiol,. 3, 207-228.
- Valkama ER, Uusitalo R, Turtola E, 2011. Yield response models to phosphorus application : A research of Finnish field trials to optimize P use of cereals. Nutr. Cycling Agroecosyst., 91 : 1-15.
- Walworth J.L., Sumner, M.E., 1987. The Diagnosis and Recommendation Integrated System (DRIS). Advances in soil science, 6 : 149-188.
- Ziadi N., Bélanger G., Cambouris A., Tremblay N., Nolin M.C., Claessens A., 2007. Relationship between P and N concentration in corn. Agron. J., 99 : 833-841. doi : 10.2134/agronj2006.0199.
- Ziadi N., Bélanger G., Cambouris A., Tremblay N., Nolin M.C., Claessens A., 2008. Relationship between phosphorus and nitrogen concentrations in spring wheat. Agron. J., 100 : 80-86. doi : 10.2134/agronj2007.0119.